HPV疫苗一针就够?业界认为实行尚早
日前,世界卫生组织(WHO)在其官网发布消息:WHO于4月4日-7日召开了免疫战略专家组(SAGE)会议,对1剂次人乳头瘤病毒 (HPV)疫苗接种的证据进行了审议。专家组审议认为,只接种1剂次HPV疫苗,可以产生和2-3剂次同样的免疫效果,可有效预防由HPV感染引起的宫颈癌。
消息公布后,话题“#HPV疫苗三针可只打一针#”冲上热搜。不少网友产生疑问:HPV疫苗打一针就够了吗?什么时候开始实行呢?
“1剂次是有前提的。”
HPV是人乳头瘤病毒,其之所以受到如此重视,是因为感染HPV可能会导致宫颈癌。几乎所有的宫颈癌都与高危型人乳头瘤病毒的持续感染密切相关,通过接种疫苗则可预防HPV感染,从而减少感染宫颈癌的概率。这也使宫颈癌成为仅有的一种具有明确病因和有效预防手段的恶性肿瘤。
目前,全球商业化的HPV疫苗主要有3类,即HPV二价疫苗、HPV四价疫苗及HPV九价疫苗。其中,价数越高,所预防的HPV型别也越多。从产品看,全球获批上市的HPV疫苗共有5款,分别是葛兰素史克的二价HPV疫苗、默沙东的四价HPV疫苗、默沙东的九价HPV疫苗、万泰生物的二价HPV疫苗、沃森生物的二价HPV疫苗。其中,后两款为国产疫苗。
上述5款HPV疫苗中,除国产二价HPV疫苗为分年龄段的2剂次和3剂次程序外,其他疫苗国内免疫程序均为3剂次。WHO发布的这则消息,是否意味着今后只接种1剂次HPV疫苗就可以了?
“1剂次是有前提的。”针对单剂次HPV疫苗接种方案可以有效预防宫颈癌话题,中国医药工业信息中心高级行业研究员盛杨佶日前接受中国经济网记者采访时指出,根据免疫战略专家组建议免疫程序,网传“HPV疫苗三针可只打一针”的说法过于笼统,并非所有人群都可以接种1剂次。免疫战略专家组建议:9岁-14岁女性(最优先人群)接种1剂次或2剂次;15岁-20岁女性接种1剂次或2剂次;21岁以上女性接种2剂次(间隔6个月)。其中,对于免疫力低下的个体,包括艾滋病病毒携带者,如果可行,应接受三剂,如果不可行,至少两剂。
1剂次对推广HPV疫苗有重要意义
既然免疫战略专家组建议,低龄女性可以实行单剂次接种方案。那么,上述免疫程序会很快在国内推广吗?
北京协和医学院群医学及公共卫生学院教授、WHO全球消除宫颈癌专家组成员乔友林日前公开表示,目前世卫组织只是“推荐”单剂次方案。这个推荐提供了一个循证医学的证据,但在国内,疫苗的使用必须由国家药监局批准,最终的接种方式、剂次还是要依照国家药监局批准的标准。
“WHO发文后,想几个月后就在国内实行,这不太现实。在这个建议真正落地之前,国内一定会有更多的临床试验来论断这种做法的有效性和可行性。目前所有已上市产品,都是以两剂或者三剂的方式接种。这些产品单针次方案到底能不能达到同样的效果,还需要验证。此外,临床试验的复制、专家共识的修改、接种规划的撰写,都需要时间和证据。但从长远看,若国内有一些相关证据,低龄女性或许可以实现1剂次接种程序。”盛杨佶分析,WHO之所以会进行上述研究,主要是基于HPV疫苗全球免疫接种计划的考量。由于市场上HPV疫苗供应紧张,加之价格又相对昂贵,一些发展中国家的HPV疫苗接种率普遍偏低。尤其在一些贫困地区,HPV疫苗的接种人群更是寥寥无几。在此背景下,WHO进行上述试验,目的为了加快HPV疫苗全球免疫接种进程。而这一研究,对国内HPV疫苗的推广方式具有重要参考意义。
业界认为1剂次方案获批的可能性不高
记者注意到,在WHO发布这一免疫接种建议后,我国HPV疫苗股连日来“跌跌不休”。那么,这一建议会对我国HPV疫苗市场产生怎样的影响呢?
盛杨佶分析:“如果实施1剂次方案,会很大程度上可以促进各地免疫规划进程,使得HPV疫苗市场在几年内依然会保持较高的增速。只是在市场总量的预估和峰值销售额预估方面,相比于之前(3剂次接种程序),资本市场会更悲观一点。当然,是否开展更多临床研究、发掘更多临床证据,以推动1剂次方案在我国的落地,对此疫苗生产企业可能有研发难度、市场空间等方面综合的考量。”
记者注意到,日前,针对单剂次疫苗的可行性问题,默沙东总部媒体发言人对外表示,单剂次HPV疫苗方案存在很大的不确定性,目前其对某些HPV相关癌症和疾病的长期保护力数据非常有限,同时,也没有数据显示其对HPV引发的非宫颈癌的癌症以及对其他部分群体如男性和免疫受损人群的有效性。目前,默沙东正在进行Gardasil九价疫苗的相关研究,模拟不同剂量接种方案提供的保护持续时间和潜在的公共卫生影响。
太平洋证券则分析,国内单针HPV推行可能性很小,HPV疫苗接种程序不变,市场容量不改。一方面,从国家药品监督管理局对于WHO的关于HPV方面建议的历史采纳情况来看,单针法获批的可能性比较低,主要原因是其保护力没有得到充分证明。从历史角度来看,WHO在GSK和MSD上市两款HPV疫苗后,曾建议以持续感染数据来替代宫颈癌的癌前病变Ⅱ级(CINⅡ)作为临床终点。建议的目的在于可以减少HPV疫苗临床试验的时间。但是我国药监部门出于安全性和保护力的考虑,坚持以CINⅡ为临床终点(2价HPV),从而可以切实保证疫苗的保护效果。从这个角度而言,单针法被批准的可能性不高。
另一方面,企业推动力不足。企业如果希望通过改变接种程序来竞争WHO市场的话,首先要通过本国药监部门的批准。按照国内的审批流程,企业必须先做出成年组的临床保护性数据(以CINⅡ为临床终点),然后才有可能通过改变接种方式来获得审批,但是与此同时,由于提交了新的接种程序,在审查时候会有更多方面的数据需要审批,导致整体审批时间会更加漫长,企业会为此付出更高的时间和成本。从投入产出比来看,企业主动推动单针法的动力不足。
建议国内企业加强研究、发现机遇
近年来,国内HPV疫苗市场发展势不可挡。根据中国医药工业信息中心统计,按批签发量与中标价格估算,HPV疫苗是2020年中国销售额最高的疫苗之一,市场规模已由2017年10亿元增长至2020年136亿元。不容忽视的是,这一过程中,默沙东、GSK等外资企业却占据着主导地位。
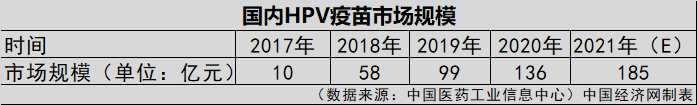
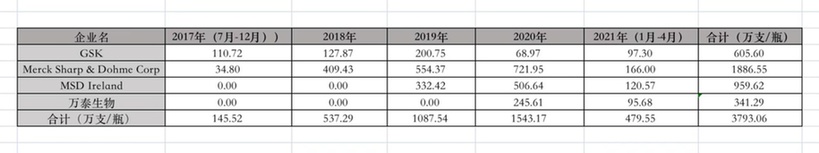
图为国内HPV疫苗批签发情况。(来源:中国医药工业信息中心)
数据显示,截至2021年4月,国内4款上市HPV疫苗(沃森生物HPV疫苗于今年3月上市)的批签发量达到3793.06万支/瓶,除万泰生物341.29万支/瓶外,其余都为外资企业,其中重要原因之一便是国产疫苗上市较晚。可喜的是,自2019年首款国产HPV疫苗上市后,2020年—2021年,国产疫苗的批签发量在一定程度上已与外资企业旗鼓相当。不过,市场仍然面临“一针难求”的局面。
“HPV疫苗1剂次方案仍存巨大数据缺口,尤其是多人种、多类型疫苗的试验数据。”盛杨佶分析,“1剂次方案有利于缓解HPV疫苗产能供应问题。如果国内机构或市场后来者能够复制SAGE的这一结论,则是差异化竞争的一大机遇。比如,1剂次的接种程序价格本身比较低,如果能去偏远地区推广覆盖,对产品渗透率和市场占有率更为有利。”
与此同时,盛杨佶也对开发难度作出提示,“企业也需要评估技术难度和审评审批标准,我个人认为难度不低。”(记者郭文培)
版权声明:凡注明“来源:中国西藏网”或“中国西藏网文”的所有作品,版权归高原(北京)文化传播有限公司。任何媒体转载、摘编、引用,须注明来源中国西藏网和署著作者名,否则将追究相关法律责任。
 中国西藏网微博
中国西藏网微博 中国西藏网微信
中国西藏网微信






